Oksidasi
Oksidasi dapat didefinisikan sebagai penambahan oksigen ke molekul atau penghapusan hidrogen dari molekul. Berikut Contohnya: Kristal asam benzoat dalam cahaya terpolarisasi yang digambarkan di bawah. Asam benzoat banyak digunakan sebagai pengawet makanan, baik sebagai asam karboksilat atau garam natrium benzoat.
Senyawa ini adalah paling efektif ketika ditambahkan ke makanan asam seperti jus buah dan minuman ringan. Sumber industri utama asam benzoat adalah oksidasi parsial toluena dengan oksigen. Proses ini murah dan ramah lingkungan.Reaksi oksidasi
Oksidasi dapat didefinisikan sebagai penambahan oksigen ke molekul atau penghapusan hidrogen dari molekul. Ketika sebuah alkana dipanaskan dengan adanya katalis yang tepat, dapat dioksidasi menjadi alkena yang sesuai pada reaksi yang disebut reaksi dehidrogenasi.
Dua atom hidrogen dihilangkan dalam proses. Alkena dapat lebih teroksidasi menjadi sebuah alkuna dengan penghapusan dua atom hidrogen lainnya.
Reaksi reversibel, sehingga sebuah alkuna dapat direduksi yang pertama alkena dan kemudian ke alkana.
Alkana adalah bentuk paling tereduksi hidrokarbon, sementara alkuna adalah bentuk yang paling teroksidasi.
Reaksi oksidasi dalam kimia organik sering melibatkan penambahan oksigen ke suatu senyawa, yang mengubah gugus fungsional tertentu senyawa tersebut. Urutan berikut menunjukkan bagaimana metana dapat dioksidasi yang pertama metana, kemudian metanol, kemudian asam methanoic, dan akhirnya menjadi karbon dioksida.
Reaksi oksidasi dalam kimia organik sering melibatkan penambahan oksigen ke suatu senyawa, yang mengubah gugus fungsional tertentu senyawa tersebut. Urutan berikut menunjukkan bagaimana metana dapat dioksidasi yang pertama metana, kemudian metanol, kemudian asam methanoic, dan akhirnya menjadi karbon dioksida.
Setiap langkah dalam proses ini adalah baik salah satu mendapatkan oksigen atau kehilangan hidrogen. Setiap langkah juga melepaskan energi, yang menjelaskan mengapa pembakaran sempurna alkana menjadi karbon dioksida merupakan reaksi yang sangat eksotermik.
Oksidasi alkohol dapat menghasilkan baik aldehida atau keton. Etanol dapat dioksidasi di laboratorium melalui proses pemanasan yang dikombinasikan dengan penambahan zat pengoksidasi seperti ion dikromat, yang mengkatalisis reaksi dalam larutan asam. Reaksi menghasilkan etanal aldehida (asetaldehida).

Ketika alkohol yang akan teroksidasi adalah alkohol sekunder, produk oksidasi adalah keton bukannya aldehida. Oksidasi alkohol sekunder sederhana, 2-propanol, menghasilkan propanon.
Alkohol tersier tidak dapat dioksidasi dengan cara ini karena karbon dimana gugus hidroksil terpasang tidak memiliki atom hidrogen lain yang melekat padanya.
Ketika alkohol primer dioksidasi menjadi aldehida, reaksi sulit untuk berhenti karena aldehida mudah teroksidasi lebih lanjut menjadi asam karboksilat yang sesuai. Oksidasi etanal menghasilkan asam etanoat (asetat).

Ethanol yang dikandung minuman seperti anggur yang rentan terhadap oksidasi seperti jika disimpan untuk jangka waktu yang lama setelah sebelumnya dibuka dan terkena udara. Minuman Anggur yang telah menjadi teroksidasi akan memiliki rasa cuka menyenangkan karena produksi asam asetat.
Tidak seperti aldehida, keton tahan terhadap oksidasi lebih lanjut karena gugus karbonil adalah di tengah-tengah rantai karbon dan keton sehingga tidak dapat diubah menjadi asam karboksilat
Perbedaan reduksi dan oksidasi
Reaksi kimia antara senyawa yang berbeda yang disebut reaksi redoks. Redoks adalah singkatan untuk reduksi-oksidasi yang adalah apa yang terjadi pada reaksi kimia. Sementara oksidasi mengacu pada hilangnya elektron, reduksi adalah bertambahnya kembali elektron. Dalam kata-kata sederhana, perubahan bilangan oksidasi atom meringkas baik oksidasi dan reduksi. Reaksi ini dapat sederhana atau kompleks tergantung pada proses dan atom yang terlibat.
Oksidasi dapat digambarkan sebagai peningkatan bilangan oksidasi sedangkan reduksi adalah kondisi penurunan bilangan oksidasi. Meskipun Transfer (penambahan atau penurunan) elektron merupakan prasyarat reaksi redoks, ada reaksi di mana tidak ada transfer elektron. Ini disebut sebagai reaksi metatesis.
Perbedaan utama antara reduksi dan oksidasi terletak pada penambahan dan pengurangan dari elektron. Sementara oksidasi melibatkan kehilangan elektron, reduksi adalah ketika ada penambahan elektron. Reaksi redoks seimbang dalam arti bahwa jumlah elektron yang hilang oleh molekul yang sama dengan elektron yang diperoleh oleh molekul lain dalam reaksi.
Elektron hilang oleh molekul bergeser ke molekul tetangga yang menerimanya. Proses penambahan dan pengurangan dari elektron terus sepanjang waktu dengan beberapa reaksi yang sedemikian rupa sehingga kita dapat mengamati secara fisik dalam kehidupan kita sehari-hari.
Misalnya ketika kita memotong sebuah apel dan membiarkannya terbuka selama beberapa waktu, warna apel berubah menjadi coklat yang menunjukkan bahwa telah teroksidasi. Demikian pula besi mendapatkan teroksidasi tercermin dari pembentukan karat di atasnya.
Logam adalah agen reduksi dan korosi mereka mencerminkan reduksi mereka. Besi mereduksi ke oksidanya yang disebut karat yang memakan besi sementara seng mereduksi ke oksidanya dengan tidak merugikan dan membentuk lapisan pelindung di atas seng.
Secara singkat Perbedaan reduksi dan oksidasi:
- Reduksi dan oksidasi adalah proses kimia yang terlibat dalam setiap reaksi kimia.
- Oksidasi berarti kehilangan elektron sedangkan reduksi mengacu untuk mendapatkan elektron
- Oksidasi disebut mengalami peningkatan bilangan oksidasi sedangkan reduksi adalah penurunan bilangan oksidasi
- Reaksi redoks dapat dilihat secara praktis dalam situasi kehidupan sehari-hari
Redoks
Redoks adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia.
Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana (CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit.
Istilah redoks berasal dari dua konsep, yaitu reduksi dan oksidasi. Ia dapat dijelaskan dengan mudah sebagai berikut:
- Oksidasi menjelaskan pelepasan elektron oleh sebuah molekul, atom, atau ion
- Reduksi menjelaskan penambahan elektron oleh sebuah molekul, atom, atau ion.
Walaupun cukup tepat untuk digunakan dalam berbagai tujuan, penjelasan di atas tidaklah persis benar. Oksidasi dan reduksi tepatnya merujuk pada perubahan bilangan oksidasi karena transfer elektron yang sebenarnya tidak akan selalu terjadi. Sehingga oksidasi lebih baik didefinisikan sebagai peningkatan bilangan oksidasi, dan reduksi sebagai penurunan bilangan oksidasi. Dalam praktiknya, transfer elektron akan selalu mengubah bilangan oksidasi, namun terdapat banyak reaksi yang diklasifikasikan sebagai "redoks" walaupun tidak ada transfer elektron dalam reaksi tersebut (misalnya yang melibatkan ikatan kovalen).
Reaksi non-redoks yang tidak melibatkan perubahan muatan formal (formal charge) dikenal sebagai reaksi metatesis.
Senyawa-senyawa yang memiliki kemampuan untuk mengoksidasi senyawa lain dikatakan sebagai oksidatif dan dikenal sebagai oksidator atau agen pengoksidasi. Oksidator melepaskan elektron dari senyawa lain, sehingga dirinya sendiri tereduksi. Oleh karena ia "menerima" elektron, ia juga disebut sebagai penerima elektron. Oksidator bisanya adalah senyawa-senyawa yang memiliki unsur-unsur dengan bilangan oksidasi yang tinggi (seperti H2O2, MnO−4, CrO3, Cr2O2−7, OsO4) atau senyawa-senyawa yang sangat elektronegatif, sehingga dapat mendapatkan satu atau dua elektron yang lebih dengan mengoksidasi sebuah senyawa (misalnya oksigen, fluorin, klorin, dan bromin).
Senyawa-senyawa yang memiliki kemampuan untuk mereduksi senyawa lain dikatakan sebagai reduktif dan dikenal sebagai reduktor atau agen pereduksi. Reduktor melepaskan elektronnya ke senyawa lain, sehingga ia sendiri teroksidasi. Oleh karena ia "mendonorkan" elektronnya, ia juga disebut sebagai penderma elektron. Senyawa-senyawa yang berupa reduktor sangat bervariasi. Unsur-unsur logam seperti Li, Na, Mg, Fe, Zn, dan Al dapat digunakan sebagai reduktor. Logam-logam ini akan memberikan elektronnya dengan mudah. Jenis reduktor lainnya adalah reagen transfer hidrida, misalnya NaBH4 dan LiAlH4), reagen-reagen ini digunakan dengan luas dalam kimia organik, terutama dalam reduksi senyawa-senyawa karbonil menjadi alkohol. Metode reduksi lainnya yang juga berguna melibatkan gas hidrogen (H2) dengan katalis paladium, platinum, atau nikel, Reduksi katalitik ini utamanya digunakan pada reduksi ikatan rangkap dua ata tiga karbon-karbon.
Cara yang mudah untuk melihat proses redoks adalah, reduktor mentransfer elektronnya ke oksidator. Sehingga dalam reaksi, reduktor melepaskan elektron dan teroksidasi, dan oksidator mendapatkan elektron dan tereduksi. Pasangan oksidator dan reduktor yang terlibat dalam sebuah reaksi disebut sebagai pasangan redoks.
Contoh reaksi redoks
Kita dapat menulis keseluruhan reaksi ini sebagai dua reaksi setengah: reaksi oksidasi
dan reaksi reduksi
Penganalisaan masing-masing reaksi setengah akan menjadikan keseluruhan proses kimia lebih jelas. Karena tidak terdapat perbuahan total muatan selama reaksi redoks, jumlah elektron yang berlebihan pada reaksi oksidasi haruslah sama dengan jumlah yang dikonsumsi pada reaksi reduksi.
Unsur-unsur, bahkan dalam bentuk molekul, sering kali memiliki bilangan oksidasi nol. Pada reaksi di atas, hidrogen teroksidasi dari bilangan oksidasi 0 menjadi +1, sedangkan fluorin tereduksi dari bilangan oksidasi 0 menjadi -1.
Ketika reaksi oksidasi dan reduksi digabungkan, elektron-elektron yang terlibat akan saling mengurangi:
Dan ion-ion akan bergabung membentuk hidrogen fluorida:
Reaksi penggantian
Redoks terjadi pada reaksi penggantian tunggal atau reaksi substitusi. Komponen redoks dalam tipe reaksi ini ada pada perubahan keadaan oksidasi (muatan) pada atom-atom tertentu, dan bukanlah pada pergantian atom dalam senyawa.
Sebagai contoh, reaksi antara larutan besi dan tembaga(II) sulfat:
Persamaan ion dari reaksi ini adalah:
Terlihat bahwa besi teroksidasi:
dan tembaga tereduksi:
Contoh-contoh lainnya
- Besi(II) teroksidasi menjadi besi(III)
- hidrogen peroksida tereduksi menjadi hidroksida dengan keberadaan sebuah asam:
Persamaan keseluruhan reaksi di atas adalah:
- denitrifikasi, nitrat tereduksi menjadi nitrogen dengan keberadaan asam:
- 2NO−3 + 10e− + 12 H+ → N2 + 6H2O
- Besi akan teroksidasi menjadi besi(III) oksida dan oksigen akan tereduksi membentuk besi(III) oksida (umumnya dikenal sebagai perkaratan):
- 4Fe + 3O2 → 2 Fe2O3
- Pembakaran hidrokarbon, contohnya pada mesin pembakaran dalam, menghasilkan air, karbon dioksida, sebagian kecil karbon monoksida, dan energi panas. Oksidasi penuh bahan-bahan yang mengandung karbon akan menghasilkan karbon dioksida.
- Dalam kimia organik, oksidasi seselangkah (stepwise oxidation) hidrokarbon menghasilkan air, dan berturut-turut alkohol, aldehida atau keton, asam karboksilat, dan kemudian peroksida.
Reaksi redoks dalam industri
Proses utama pereduksi bijih logam untuk menghasilkan logam didiskusikan dalam artikel peleburan.
Oksidasi digunakan dalam berbagai industri seperti pada produksi produk-produk pembersih.
Reaksi redoks juga merupakan dasar dari sel elektrokimia.
Reaksi redoks dalam biologi
Banyak proses biologi yang melibatkan reaksi redoks. Reaksi ini berlangsung secara simultan karena sel, sebagai tempat berlangsungnya reaksi-reaksi biokimia, harus melangsungkan semua fungsi hidup. Agen biokimia yang mendorong terjadinya oksidasi terhadap substansi berguna dikenal dalam ilmu pangan dan kesehatan sebagai oksidan. Zat yang mencegah aktivitas oksidan disebut antioksidan.
Pernapasan sel, contohnya, adalah oksidasi glukosa (C6H12O6) menjadi CO2 dan reduksi oksigen menjadi air. Persamaan ringkas dari pernapasan sel adalah:
- C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
- Proses pernapasan sel juga sangat bergantung pada reduksi NAD+ menjadi NADH dan reaksi baliknya (oksidasi NADH menjadu NAD+). Fotosintesis secara esensial merupakan kebalikan dari reaksi redoks pada pernapasan sel:
- 6 CO2 + 6 H2O + light energy → C6H12O6 + 6 O2
Energi biologi sering disimpan dan dilepaskan dengan menggunakan reaksi redoks. Fotosintesis melibatkan reduksi karbon dioksida menjadi guladan oksidasi air menjadi oksigen. Reaksi baliknya, pernapasan, mengoksidasi gula, menghasilkan karbon dioksida dan air. Sebagai langkah antara, senyawa karbon yang direduksi digunakan untuk mereduksi nikotinamida adenina dinukleotida (NAD+), yang kemudian berkontribusi dalam pembentukan gradien proton, yang akan mendorong sintesis adenosina trifosfat (ATP) dan dijaga oleh reduksi oksigen. Pada sel-sel hewan, mitokondria menjalankan fungsi yang sama. Lihat pula Potensial membran.
Istilah keadaan redoks juga sering digunakan untuk menjelaskan keseimbangan antara NAD+/NADH dengan NADP+/NADPH dalam sistem biologi seperti pada sel dan organ. Keadaan redoksi direfleksikan pada keseimbangan beberapa set metabolit (misalnya laktat dan piruvat, beta-hidroksibutirat dan asetoasetat) yang antarubahannya sangat bergantung pada rasio ini. Keadaan redoks yang tidak normal akan berakibat buruk, seperti hipoksia, guncangan (shock), dan sepsis.
Siklus redoks
Berbagai macam senyawa aromatik direduksi oleh enzim untuk membentuk senyawa radikal bebas. Secara umum, penderma elektronnya adalah berbagai jenis flavoenzimdan koenzim-koenzimnya. Seketika terbentuk, radikal-radikal bebas anion ini akan mereduksi oskigen menjadi superoksida. Reaksi bersihnya adalah oksidasi koenzim flavoenzim dan reduksi oksigen menjadi superoksida. Tingkah laku katalitik ini dijelaskan sebagai siklus redoks.
Contoh molekul-molekul yang menginduksi siklus redoks adalah herbisida parakuat, dan viologen dan kuinon lainnya seperti menadion.
Menyeimbangkan reaksi redoks
Untuk menuliskan keseluruhan reaksi elektrokimia sebuah proses redoks, diperlukan penyeimbangan komponen-komponen dalam reaksi setengah. Untuk reaksi dalam larutan, hal ini umumnya melibatkan penambahan ion H+, ion OH-, H2O, dan elektron untuk menutupi perubahan oksidasi.
Media asam
Pada media asam, ion H+ dan air ditambahkan pada reaksi setengah untuk menyeimbangkan keseluruhan reaksi. Sebagai contoh, ketika mangan(II) bereaksi dengan natrium bismutat:
Reaksi ini diseimbangkan dengan mengatur reaksi sedemikian rupa sehingga dua setengah reaksi tersebut melibatkan jumlah elektron yang sama (yakni mengalikan reaksi oksidasi dengan jumlah elektron pada langkah reduksi, demikian juga sebaliknya).
Reaksi diseimbangkan:
Hal yang sama juga berlaku untuk sel bahan bakar propana di bawah kondisi asam:
Dengan menyeimbangkan jumlah elektron yang terlibat:
Persamaan diseimbangkan:
Media basa
Pada media basa, ion OH- dan air ditambahkan ke reaksi setengah untuk menyeimbangkan keseluruhan reaksi.Sebagai contoh, reaksi antara kalium permanganat dan natrium sulfit:
Dengan menyeimbangkan jumlah elektron pada kedua reaksi setengah di atas:
Persamaan diseimbangkan:
Reaksi Reduksi Oksidasi (Redoks)
PENGERTIAN REDUKSI OKSIDASI
Pengikatan Oksigen :
Senyawa yang terbentuk dari hasil reaksi dengan oksigen dinamakan oksida sehingga reaksi antara oksigen dan suatu unsur dinamakan reaksi oksidasi. Karat besi adalah senyawa yang terbentuk dari hasil reaksi antara besi dan oksigen (besi oksida). Perkaratan besi merupakan salah satu contoh dari reaksi oksidasi. Persamaan reaksi pembentukan oksida besi dapat ditulis sebagai berikut.
Pada reaksi tersebut, besi mengalami oksidasi dengan cara mengikat oksigen menjadi besi oksida. Kebalikan dari reaksi oksidasi dinamakan reaksi reduksi. Pada reaksi reduksi terjadi pelepasan oksigen. Besi oksida dapat direduksi dengan cara direaksikan dengan gas hidrogen, persamaan reaksinya:
Pelepasan dan Penerimaan Elektron
Dalam konsep redoks, peristiwa pelepasan elektron dinamakan oksidasi, sedangkan peristiwa penerimaan elektron dinamakan reduksi. Reaksi redoks pada peristiwa perkaratan besi dapat dijelaskan dengan reaksi berikut:
 Pada reaksi tersebut, enam elektron dilepaskan oleh dua atom besi dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh karena itu, peristiwa oksidasi selalu disertai peristiwa reduksi. Pada setiap persamaan reaksi, massa dan muatan harus setara antara ruas kanan dan ruas kiri (ingat kembali penulisan persamaan reaksi). Persamaan reaksi redoks tersebut memiliki muatan dan jumlah atom yang sama antara ruas sebelah kiri dan sebelah kanan persamaan reaksi. Oksidasi besi netral melepaskan elektron yang membuatnya kehilangan muatan. Dengan menyamakan koefisiennya maka muatan pada kedua ruas persamaan reaksi menjadi sama. Penyetaraan pada reaksi reduksi oksigen juga menggunakan cara yang sama.
Pada reaksi tersebut, enam elektron dilepaskan oleh dua atom besi dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh karena itu, peristiwa oksidasi selalu disertai peristiwa reduksi. Pada setiap persamaan reaksi, massa dan muatan harus setara antara ruas kanan dan ruas kiri (ingat kembali penulisan persamaan reaksi). Persamaan reaksi redoks tersebut memiliki muatan dan jumlah atom yang sama antara ruas sebelah kiri dan sebelah kanan persamaan reaksi. Oksidasi besi netral melepaskan elektron yang membuatnya kehilangan muatan. Dengan menyamakan koefisiennya maka muatan pada kedua ruas persamaan reaksi menjadi sama. Penyetaraan pada reaksi reduksi oksigen juga menggunakan cara yang sama.
Contoh Reaksi Reduksi Oksidasi berdasarkan Transfer elektron
 Dari persamaan tersebut, dapat diketahui bahwa Mg melepaskan elektron dan Cl menerima elektron. Dengan demikian, Mg mengalami oksidasi dan Cl mengalami reduksi.
Dari persamaan tersebut, dapat diketahui bahwa Mg melepaskan elektron dan Cl menerima elektron. Dengan demikian, Mg mengalami oksidasi dan Cl mengalami reduksi.
Reduktor dan Oksidator
Dalam reaksi redoks, pereaksi yang dapat mengoksidasi pereaksi lain dinamakan zat pengoksidasi atau oksidator. Sebaliknya, zat yang dapat mereduksi zat lain dinamakan zat pereduksi atau reduktor. Pada Contoh diatas, Magnesium melepaskan elektron yang menyebabkan klorin mengalami reduksi. Dalam hal ini, magnesium disebut zat pereduksi atau reduktor. Sebaliknya, atom klorin berperan dalam mengoksidasi magnesium sehingga klorin disebut oksidator.
Contoh Reduktor dan Oksidator
Reaksi Redoks Berdasarkan Perubahan Bilangan Oksidasi
Bagaimana bilangan oksidasi dapat menjelaskan reaksi redoks? Apa Anda cukup puas dengan konsep transfer elektron? Tinjau antara reaksi SO2 dengan O2 membentuk SO3. Reaksinya dapat dituliskan sebagai berikut :
Jika dikaji berdasarkan konsep pengikatan oksigen maka reaksi tersebut adalah reaksi oksidasi. Jika dikaji berdasarkan transfer elektron maka Anda mungkin akan bingung, mengapa? Pada reaksi tersebut tidak terjadi transfer elektron, tetapi terjadi penggunaan bersama pasangan elektron membentuk ikatan kovalen. Reaksi tersebut tidak dapat dijelaskan dengan konsep transfer elektron.
Oleh karena banyak reaksi redoks yang tidak dapat dijelaskan dengan konsep pengikatan oksigen maupun transfer elektron maka para pakar kimia mengembangkan konsep alternatif, yaitu perubahan bilangan oksidasi. Menurut konsep ini, jika dalam reaksi bilangan oksidasi atom meningkat maka atom tersebut mengalami oksidasi. Sebaliknya, jika bilangan oksidasinya turun maka atom tersebut mengalami reduksi.
Untuk mengetahui suatu reaksi tergolong reaksi redoks atau bukan menurut konsep perubahan bilangan oksidasi maka perlu diketahui biloks dari setiap atom, baik dalam pereaksi maupun hasil reaksi.
Berdasarkan diagram tersebut dapat disimpulkan bahwa:
Atom S mengalami kenaikan biloks dari +4 menjadi +6, peristiwa ini disebut oksidasi; atom O mengalami penurunan biloks dari 0 menjadi –2, peristiwa ini disebut reduksi. Dengan demikian, reaksi tersebut adalah reaksi redoks.
Oleh karena molekul O2 menyebabkan molekul SO2 teroksidasi maka molekul O2 adalah oksidator. Molekul O2 sendiri mengalami reduksi akibat molekul SO2 sehingga SO2 disebut reduktor.
Permasalahan:
1. Apakah reaksi redoks dapat dikatakan sama dengan reaksi metatesis? Dan bila berbeda, apa yang membedakannya?
2. Bagaimana cara untuk merubah bilangan oksidasi agar reduksi dapat setara?
3. Apa yang terjadi jika jumlah elektron yang berlebihan pada reaksi oksidasi tidak sama dengan jumlah yang dikonsumsi pada reaksi reduks?
































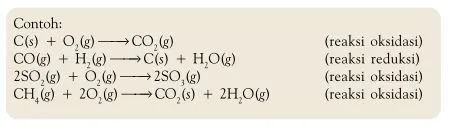

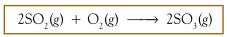


Saya akan menjawab permasalahan No 2. Bagaimana cara untuk merubah bilangan oksidasi agar reduksi dapat setara?
BalasHapusPenyetaraan persamaan reaksi redoks dengan cara perubahan bilangan oksidasi, dilakukan dengan melihat kecenderungan perubahan bilangan oksidasinya. Penyetaraan dilakukan dengan menyamakan perubahan bilangan oksidasi. Pada cara ini suasana reaksi umumnya belum diketahui (Akan diketahui dari perbedaan dari muatan pereaksi dan hasil reaksi).
Reaksi Metatesis adalah reaksi pertukaran pasangan ion dari dua elektrolit. Pada reaksi ini, setidaknya satu produk reaksi akan membentuk endapan, gas atau elektrolit lemah.
BalasHapusZat elektrolit berupa asam, basa, dan garam mempunyai kelarutan berbeda – beda. Ada yang mudah larut dan ada yang sukar larut dalam air. Untuk lebih jelasnya, perhatikan tabel berikut. dan kalau reaksi redoks Redoks adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia.
Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana (CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit.
Istilah redoks berasal dari dua konsep, yaitu reduksi dan oksidasi. menurut saya keduanya beda setelah dilihat dari definiisinya
Diantara beberapa metode atau cara menyetarakan reaksi redoks ada satu yang saya rekomendasikan untuk dipilih siswa. Metode penyetaraan persamaan reaksi redoks tersebut adalah dengan menggunakan metode setengah rekasi yang dimodifikasi. Bagian yang dimodifikasi adalah pada bagian menyetarakan jumlah atom O.
BalasHapusJika metode setengah reaksi adalah dengan menambahkan H2O pada ruas atau sisi yang kekurangan O. Pada metode setengah reaksi yang dimodifikasi ini adalah dengan menambahkan ion OH– untuk sisi yang kekurangan atom O, apapun suasana reaksinya. Urusan suasana akan disesuaikan pada tahap akhir penyetaraan. Pada metode ini tidak memerlukan perhitungan bilangan oksidasi yang untuk sebagian siswa ini kadang merasa menyulitkannya.
Adapun langkah-langkah atau tahapan penyetaraannya adalah sebagai berikut:
Membagi reaksi menjadi 2 bagian setengah reaksi, kumpulkan spesi-spesi yang memiliki kesamaan atom (kecuali O dan H tidak perlu untuk diperhatikan). Diperbolehkan menambahkan zat yang sama pada dua bagian setengah reaksi jika diperlukan;
Menyetarakan jumlah atom selain atom O dan H;
Menyetarakan jumlah atom O dengan menambahkan OH– untuk sisi yang kekurangan O dalam suasana apapun, dan menyetarakan jumlah atom H dengan menambahkan H+ untuk sisi yang kekurangan H;
Menyetarakan jumlah muatan dengan menambahkan e–;
Bila perlu mengalikan setiap setengah reaksi dengan bilangan bulat agar elektron yang dilepas sama dengan yang diterima. Ingat reaksi redoks kan reaksi serah terima elektron.
Menjumlahkan kedua setengah reaksi, dan menuliskan sisa selisih jika dijumpai spesi sama yang ada di ruas kiri dan ruas kanan;
Menambahkan H+ atau OH– (sesuai dengan suasana yang diminta) pada ruas kiri dan kanan jika diperlukan;
Jika pada satu ruas terdapat ion H+ dan juga OH– maka perlu mengonversinya jadi molekul H2O;
Memastikan jumlah atom dan muatan sudah setara.
Saya akan menjawab permasalahan yang kedua. Mengubah reaksi redoks yang belum disetarakan menjadi bentuk ion
BalasHapusCu+ H+ + NO3– ——> Cu2+ + 2 NO3– + NO + H2O
2. Menentukan bilangan oksidasi dan menuliskan dua setengah reaksi (oksidasi dan reduksi) yang menunjukkan spesies kimia yang telah mengalami perubahan bilangan oksidasi
Cu ——> Cu2+
NO3– ——> NO
3. Menyetarakan semua atom, dengan pengecualian untuk oksigen dan hidrogen
Cu ——> Cu2+
NO3– ——> NO
4. Menyetarakan atom oksigen dengan menambahkan H2O pada ruas yang kekurangan oksigen
Cu ——> Cu2+
NO3– ——> NO + 2 H2O
5. Menyetarakan atom hidrogen dengan menambahkan H+ pada ruas yang kekurangan hidrogen
Cu ——> Cu2+
4 H+ + NO3– ——> NO + 2 H2O
6. Menyetarakan muatan ion pada setiap ruas setengah reaksi dengan menambahkan elektron
Cu ——> Cu2+ + 2 e–
3 e– + 4 H+ + NO3– ——> NO + 2 H2O
7. Menyetarakan kehilangan elektron dengan perolehan elektron antara kedua setengah reaksi
3 Cu ——> 3 Cu2+ + 6 e–
6 e– + 8 H+ + 2 NO3– ——> 2 NO + 4 H2O
8. Menggabungkan kedua reaksi paruh tersebut dan menghilangkan spesi yang sama di kedua sisi; elektron selalu harus dihilangkan (jumlah elektron di kedua sisi harus sama)
3 Cu ——> 3 Cu2+ + 6 e– …………………….. (1)
6 e– + 8 H+ + 2 NO3 ——> 2 NO + 4 H2O …………………….. (2)
3 Cu + 8 H+ + 2 NO3– ——> 3 Cu2+ + 2 NO + 4 H2O …………………………….. [(1) + (2)]
9. Mengubah persamaan reaksi kembali ke bentuk molekulnya dengan menambahkan ion pengamat
3 Cu + 8 H+ + 2 NO3– + 6 NO3– ——> 3 Cu2+ + 2 NO + 4 H2O + 6 NO3–
3 Cu + 8 HNO3 ——> 3 Cu(NO3)2 + 2 NO + 4 H2O
10. Memeriksa kembali untuk meyakinkan bahwa semua atomnya telah setara, semua muatannya telah setara, dan semua koefisiennya ada dalam bentuk bilangan bulat terkecil
Metode lain yang digunakan dalam menyetarakan persamaan reaksi redoks adalah metode perubahan bilangan oksidasi (PBO).
Untuk menuliskan keseluruhan reaksi elektrokimia sebuah proses redoks, diperlukan penyeimbangan komponen-komponen dalam reaksi setengah. Untuk reaksi dalam larutan, hal ini umumnya melibatkan penambahan ion H+, ion OH-, H2O, dan elektron untuk menutupi perubahan oksidasi.
BalasHapusUntuk menuliskan keseluruhan reaksi elektrokimia sebuah proses redoks, diperlukan penyeimbangan komponen-komponen dalam reaksi setengah. Untuk reaksi dalam larutan, hal ini umumnya melibatkan penambahan ion H+, ion OH-, H2O, dan elektron untuk menutupi perubahan oksidasi.
BalasHapusSaya akan menjawab pertanyaan no 1 proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana (CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit.
BalasHapusIstilah redoks berasal dari dua konsep, yaitu reduksi dan oksidasi. menurut saya keduanya beda setelah dilihat dari definiisinya
Saya akan menjawab permasalahan No 2. Bagaimana cara untuk merubah bilangan oksidasi agar reduksi dapat setara?
BalasHapusPenyetaraan persamaan reaksi redoks dengan cara perubahan bilangan oksidasi, dilakukan dengan melihat kecenderungan perubahan bilangan oksidasinya. Penyetaraan dilakukan dengan menyamakan perubahan bilangan oksidasi. Pada cara ini suasana reaksi umumnya belum diketahui (Akan diketahui dari perbedaan dari muatan pereaksi dan hasil reaksi).
Untuk menuliskan keseluruhan reaksi elektrokimia sebuah proses redoks, diperlukan penyeimbangan komponen-komponen dalam reaksi setengah. Untuk reaksi dalam larutan, hal ini umumnya melibatkan penambahan ion H+, ion OH-, H2O, dan elektron untuk menutupi perubahan oksidasi.
BalasHapusReaksi Metatesis adalah reaksi pertukaran pasangan ion dari dua elektrolit. Pada reaksi ini, setidaknya satu produk reaksi akan membentuk endapan, gas atau elektrolit lemah.
BalasHapusZat elektrolit berupa asam, basa, dan garam mempunyai kelarutan berbeda – beda. Ada yang mudah larut dan ada yang sukar larut dalam air. Untuk lebih jelasnya, perhatikan tabel berikut. dan kalau reaksi redoks Redoks adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia.
Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana (CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit.
Istilah redoks berasal dari dua konsep, yaitu reduksi dan oksidasi. menurut saya keduanya beda setelah dilihat dari definiisinya
Menjumlahkan kedua setengah reaksi, dan menuliskan sisa selisih jika dijumpai spesi sama yang ada di ruas kiri dan ruas kanan;
BalasHapusMenambahkan H+ atau OH– (sesuai dengan suasana yang diminta) pada ruas kiri dan kanan jika diperlukan;
Jika pada satu ruas terdapat ion H+ dan juga OH– maka perlu mengonversinya jadi molekul H2O;
Memastikan jumlah atom dan muatan sudah setara.
Untuk menuliskan keseluruhan reaksi elektrokimia sebuah proses redoks, diperlukan penyeimbangan komponen-komponen dalam reaksi setengah. Untuk reaksi dalam larutan, hal ini umumnya melibatkan penambahan ion H+, ion OH-, H2O, dan elektron untuk menutupi perubahan oksidasi.
BalasHapusUntuk menuliskan keseluruhan reaksi elektrokimia sebuah proses redoks, diperlukan penyeimbangan komponen-komponen dalam reaksi setengah. Untuk reaksi dalam larutan, hal ini umumnya melibatkan penambahan ion H+, ion OH-, H2O, dan elektron untuk menutupi perubahan oksidasi.
BalasHapusjawaban permasalahan no 2
BalasHapusagaimana bilangan oksidasi dapat menjelaskan reaksi redoks? Apa Anda cukup puas dengan konsep transfer elektron? Tinjau antara reaksi SO2 dengan O2 membentuk SO3. Reaksinya dapat dituliskan sebagai berikut :
Jika dikaji berdasarkan konsep pengikatan oksigen maka reaksi tersebut adalah reaksi oksidasi. Jika dikaji berdasarkan transfer elektron maka Anda mungkin akan bingung, mengapa? Pada reaksi tersebut tidak terjadi transfer elektron, tetapi terjadi penggunaan bersama pasangan elektron membentuk ikatan kovalen. Reaksi tersebut tidak dapat dijelaskan dengan konsep transfer elektron.
Oleh karena banyak reaksi redoks yang tidak dapat dijelaskan dengan konsep pengikatan oksigen maupun transfer elektron maka para pakar kimia mengembangkan konsep alternatif, yaitu perubahan bilangan oksidasi. Menurut konsep ini, jika dalam reaksi bilangan oksidasi atom meningkat maka atom tersebut mengalami oksidasi. Sebaliknya, jika bilangan oksidasinya turun maka atom tersebut mengalami reduksi.
Untuk mengetahui suatu reaksi tergolong reaksi redoks atau bukan menurut konsep perubahan bilangan oksidasi maka perlu diketahui biloks dari setiap atom, baik dalam pereaksi maupun hasil reaksi.
Berdasarkan diagram tersebut dapat disimpulkan bahwa:
Atom S mengalami kenaikan biloks dari +4 menjadi +6, peristiwa ini disebut oksidasi; atom O mengalami penurunan biloks dari 0 menjadi –2, peristiwa ini disebut reduksi. Dengan demikian, reaksi tersebut adalah reaksi redoks.
Oleh karena molekul O2 menyebabkan molekul SO2 teroksidasi maka molekul O2 adalah oksidator. Molekul O2 sendiri mengalami reduksi akibat molekul SO2 sehingga SO2 disebut reduktor.
Nomor 2
BalasHapusUntuk menuliskan keseluruhan reaksi elektrokimia sebuah proses redoks, diperlukan penyeimbangan komponen-komponen dalam reaksi setengah. Untuk reaksi dalam larutan, hal ini umumnya melibatkan penambahan ion H+, ion OH-, H2O, dan elektron untuk menutupi perubahan oksidasi.
Oleh karena banyak reaksi redoks yang tidak dapat dijelaskan dengan konsep pengikatan oksigen maupun transfer elektron maka para pakar kimia mengembangkan konsep alternatif, yaitu perubahan bilangan oksidasi. Menurut konsep ini, jika dalam reaksi bilangan oksidasi atom meningkat maka atom tersebut mengalami oksidasi. Sebaliknya, jika bilangan oksidasinya turun maka atom tersebut mengalami reduksi.
BalasHapusUntuk mengetahui suatu reaksi tergolong reaksi redoks atau bukan menurut konsep perubahan bilangan oksidasi maka perlu diketahui biloks dari setiap atom, baik dalam pereaksi maupun hasil reaksi.
Berdasarkan diagram tersebut dapat disimpulkan bahwa:
Atom S mengalami kenaikan biloks dari +4 menjadi +6, peristiwa ini disebut oksidasi; atom O mengalami penurunan biloks dari 0 menjadi –2, peristiwa ini disebut reduksi. Dengan demikian, reaksi tersebut adalah reaksi redoks.